پروتز عصبی حرکتی
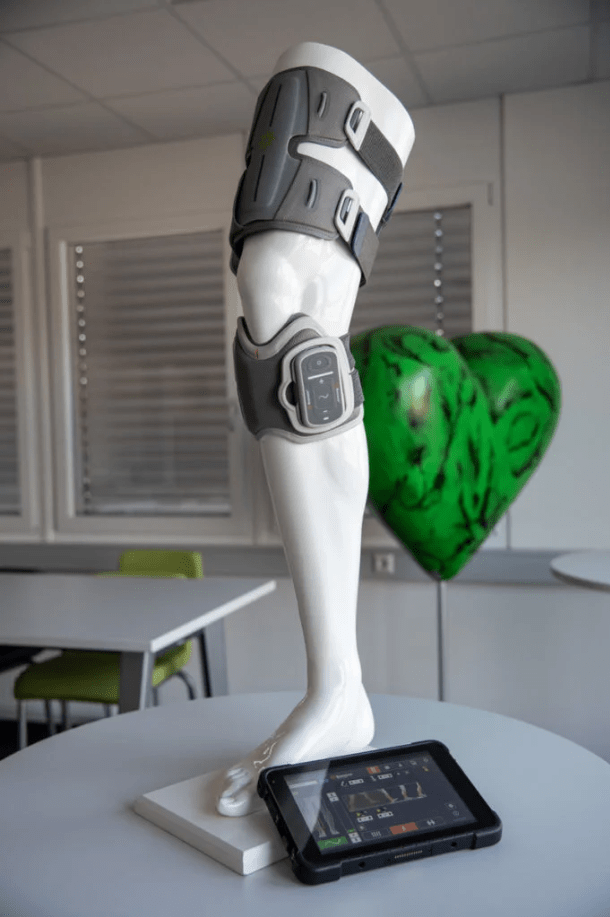
پروتزهای عصبی حرکتی با تحریک الکتریکی عملکردی (FES) نوعی فناوری پزشکی هستند که برای بازگرداندن عملکرد حرکتی به افرادی که به دلیل آسیب به سیستم عصبی مرکزی مانند آسیب نخاعی یا سکته، توانایی حرکت خود را از دست دادهاند، استفاده میشوند. این پروتزها با استفاده از الکترودهایی که به اعصاب یا عضلات مرتبط با حرکت متصل میشوند، سیگنالهای الکتریکی را به بافتهای هدف ارسال میکنند. این تحریک الکتریکی باعث انقباض عضلات و در نتیجه ایجاد حرکت میشود. هدف اصلی این پروتزها، بهبود کنترل حرکتی و افزایش استقلال بیماران در انجام فعالیتهای روزانه است.یکی از مثالهای بارز این نوع پروتزها، فوت دراپ (Foot Drop) است که در آن فرد نمیتواند بهدرستی پا را در هنگام راه رفتن بلند کند. در این حالت، پروتزهای FES میتوانند با تحریک الکتریکی عضلات جلوی ساق پا، حرکت طبیعی بلند کردن پا را شبیهسازی کنند. از دیگر مثالها میتوان به تحریک عضلات بازو برای کمک به بیماران دچار سکته جهت بازگرداندن کنترل در حرکات دست و بازو اشاره کرد. این تکنولوژی همچنین در بازتوانی بیمارانی که دچار ضعف عضلانی هستند، بسیار کاربردی است.
مقالات مرتبط
1. Holinski, B. J., Mazurek, K. A., Everaert, D. G., Toossi, A., Lucas-Osma, A. M., Troyk, P., ... & Mushahwar, V. K. (2016). Intraspinal microstimulation produces over-ground walking in anesthetized cats. Journal of neural engineering, 13(5), 056016.
2. Dalrymple, A. N., Roszko, D. A., Sutton, R. S., & Mushahwar, V. K. (2020). Pavlovian control of intraspinal microstimulation to produce over-ground walking. Journal of neural engineering, 17(3), 036002.
3. Rouhani, E., & Erfanian, A. (2018). Block-based robust control of stepping using intraspinal microstimulation. Journal of Neural Engineering, 15(4), 046026.
4. Roshani, A., & Erfanian, A. (2015). The effects of stimulation strategy on joint movement elicited by intraspinal microstimulation. IEEE Transactions on Neural Systems and Rehabilitation Engineering, 24(7), 794-805.
5. Shah, P. K., & Lavrov, I. (2017). Spinal epidural stimulation strategies: clinical implications of locomotor studies in spinal rats. The Neuroscientist, 23(6), 664-680.
6. Lavrov, I., Dy, C. J., Fong, A. J., Gerasimenko, Y., Courtine, G., Zhong, H., ... & Edgerton, V. R. (2008). Epidural stimulation induced modulation of spinal locomotor networks in adult spinal rats. Journal of Neuroscience, 28(23), 6022-6029.
7. Raspopovic, S., Capogrosso, M., Petrini, F. M., Bonizzato, M., Rigosa, J., Di Pino, G., ... & Micera, S. (2014). Restoring natural sensory feedback in real-time bidirectional hand prostheses. Science translational medicine, 6(222), 222ra19-222ra19.
8. Powell, M. P., Verma, N., Sorensen, E., Carranza, E., Boos, A., Fields, D., ... & Capogrosso, M. (2022). Epidural stimulation of the cervical spinal cord improves voluntary motor control in post-stroke upper limb paresis. medRxiv, 2022-04.
پل نخاعی
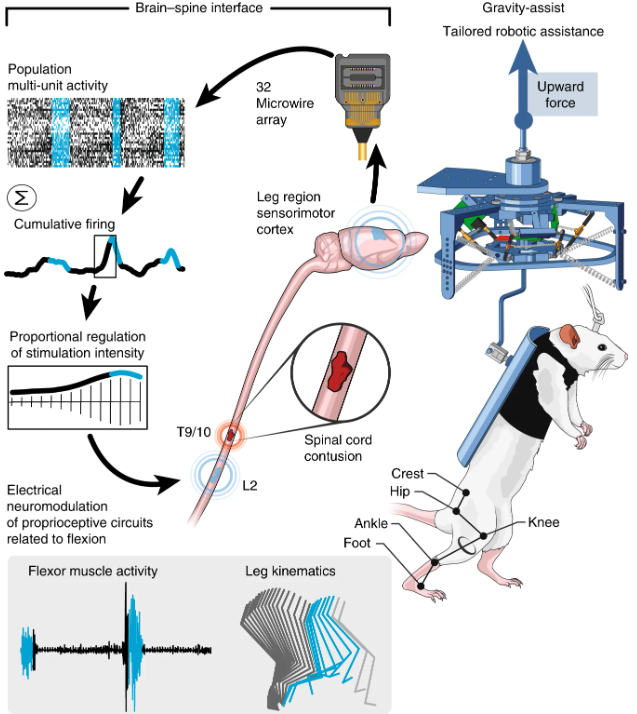
قطع نخاع زمانی رخ میدهد که نخاع در اثر آسیب شدید بهطور کامل یا جزئی دچار گسستگی شود و ارتباط میان مغز و بخشهای پایینی بدن قطع شود. این آسیب میتواند منجر به از دست رفتن توانایی حرکت، حسی، و کنترل اندامها شود. اخیراً، تکنولوژیهای پیشرفته مانند "پل نخاعی" بهعنوان روشی جدید برای بازگرداندن عملکرد عصبی در افراد دچار قطع نخاع مطرح شدهاند. این فناوری شامل اتصال به دو بخش سالم و آسیبدیده نخاع متصل میباشد که از طریق الکترودهای کوچک، سیگنالهای الکتریکی را از بخش سالم نخاع دریافت میکند و سپس این سیگنالها را بهصورت مستقیم یا با پردازش و تقویت، به بخش آسیبدیده منتقل میکند. به این ترتیب، مسیر عصبی که بهواسطه آسیب قطع شده بود، بهطور مصنوعی بازسازی میشود. آزمایشهای اولیه نشان دادهاند که این روش میتواند به بهبود قابل توجهی در بازیابی حرکت و حواس در بیماران کمک کند و به آنها امکان بازگشت به زندگی عادیتر را بدهد. با این حال، این تکنولوژی همچنان در مراحل اولیه توسعه قرار دارد و تحقیقات بیشتری برای بهینهسازی و افزایش اثربخشی آن مورد نیاز است. هم اکنون آزمایشات حیوانی این روش بر روی موش توسط تیم دکتر کورتین در دانشگاه EPFL با موفقیت سپری شده است.
مقالات مرتبط
1. Holinski, B. J., Mazurek, K. A., Everaert, D. G., Toossi, A., Lucas-Osma, A. M., Troyk, P., ... & Mushahwar, V. K. (2016). Intraspinal microstimulation produces over-ground walking in anesthetized cats. Journal of neural engineering, 13(5), 056016.
2. Dalrymple, A. N., Roszko, D. A., Sutton, R. S., & Mushahwar, V. K. (2020). Pavlovian control of intraspinal microstimulation to produce over-ground walking. Journal of neural engineering, 17(3), 036002.
3. Rouhani, E., & Erfanian, A. (2018). Block-based robust control of stepping using intraspinal microstimulation. Journal of Neural Engineering, 15(4), 046026.
4. Roshani, A., & Erfanian, A. (2015). The effects of stimulation strategy on joint movement elicited by intraspinal microstimulation. IEEE Transactions on Neural Systems and Rehabilitation Engineering, 24(7), 794-805.
5. Shah, P. K., & Lavrov, I. (2017). Spinal epidural stimulation strategies: clinical implications of locomotor studies in spinal rats. The Neuroscientist, 23(6), 664-680.
6. Lavrov, I., Dy, C. J., Fong, A. J., Gerasimenko, Y., Courtine, G., Zhong, H., ... & Edgerton, V. R. (2008). Epidural stimulation induced modulation of spinal locomotor networks in adult spinal rats. Journal of Neuroscience, 28(23), 6022-6029.
7. Raspopovic, S., Capogrosso, M., Petrini, F. M., Bonizzato, M., Rigosa, J., Di Pino, G., ... & Micera, S. (2014). Restoring natural sensory feedback in real-time bidirectional hand prostheses. Science translational medicine, 6(222), 222ra19-222ra19.
8. Powell, M. P., Verma, N., Sorensen, E., Carranza, E., Boos, A., Fields, D., ... & Capogrosso, M. (2022). Epidural stimulation of the cervical spinal cord improves voluntary motor control in post-stroke upper limb paresis. medRxiv, 2022-04.
کنترل عملکرد مثانه
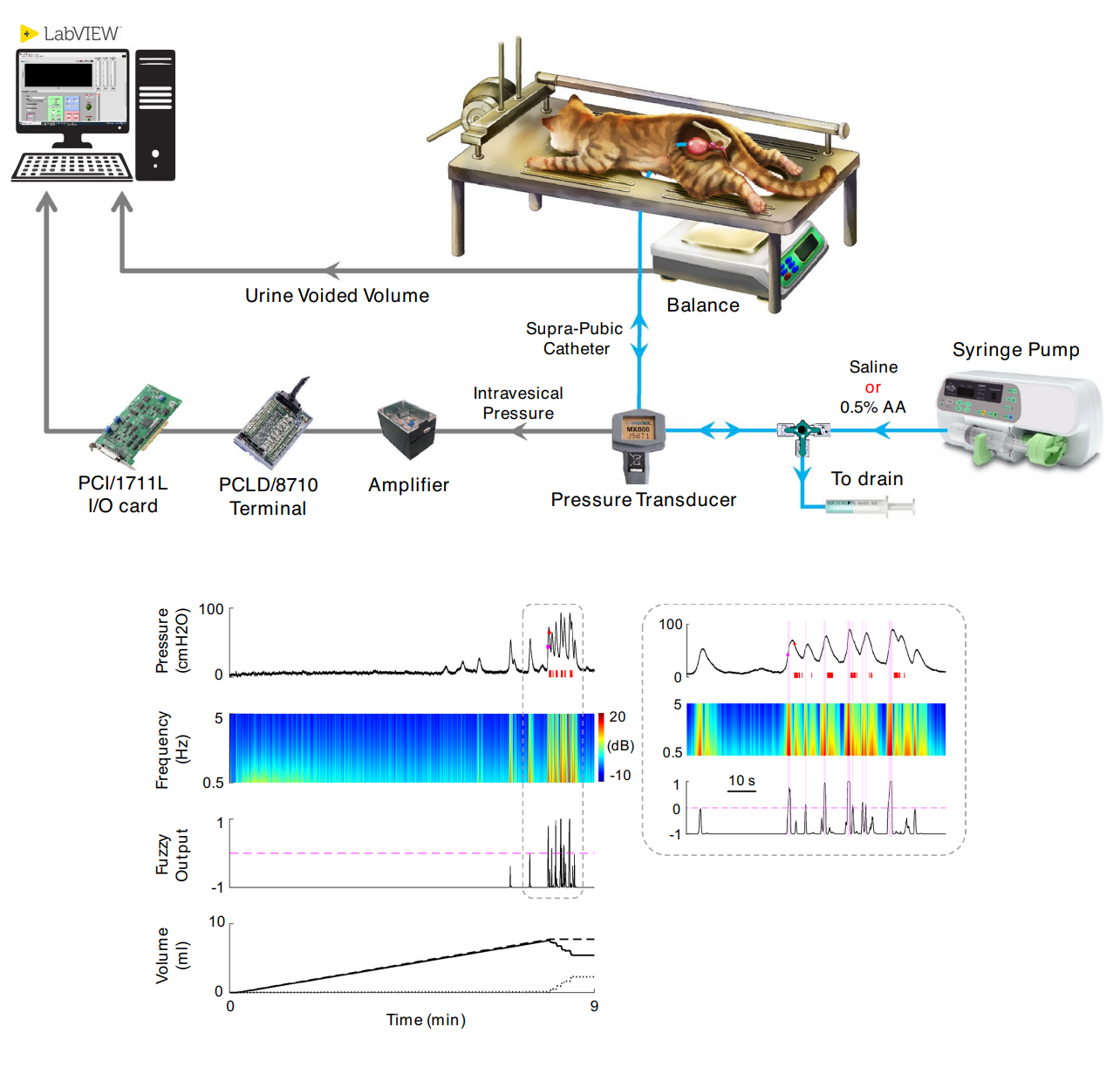
کنترل عملکرد مثانه با تحریک الکتریکی یک روش نوآورانه برای کمک به افرادی است که به دلیل آسیبهای نخاعی یا اختلالات عصبی توانایی کنترل مثانه خود را از دست دادهاند. این تکنیک با استفاده از الکترودهایی که به اعصاب کنترلکننده عملکرد مثانه مانند عصب پودندال، پلویک، ریشه ساکرال و ناحیه ساکرال نخاع متصل میشوند، سیگنالهای الکتریکی را برای تحریک این اعصاب ارسال میکند. این تحریک باعث میشود که مثانه به درستی منقبض یا شل شود و به بیماران اجازه میدهد تا دفع ادرار را بهتر کنترل کنند.این روش درمانی برای افرادی که دچار بیاختیاری ادرار یا احتباس ادرار شدهاند، بسیار مفید است. به عنوان مثال، بیمارانی که پس از آسیبهای نخاعی قادر به تخلیه کامل مثانه نیستند، میتوانند با استفاده از تحریک الکتریکی عصبی، عضلات مثانه خود را فعال کرده و جریان طبیعی ادرار را برقرار کنند. این تکنیک همچنین به بهبود کیفیت زندگی افرادی که دچار اختلالات مثانه هستند کمک کرده و در بسیاری از موارد میتواند جایگزین کاتترهای دائمی یا جراحیهای تهاجمی شود.
مقالات مرتبط
1. de Groat, W. C., Griffiths, D., & Yoshimura, N. (2015). Neural control of the lower urinary tract. Comprehensive Physiology, 5(1), 327.
2. Hokanson, J. A., Langdale, C. L., Sridhar, A., Milliken, P., & Grill, W. M. (2021). State-dependent bioelectronic interface to control bladder function. Scientific reports, 11(1), 314.3.
3. Peh, W. Y. X., Raczkowska, M. N., Teh, Y., Alam, M., Thakor, N. V., & Yen, S. C. (2018). Closed-loop stimulation of the pelvic nerve for optimal micturition. Journal of neural engineering, 15(6), 066009.
4. Qasemi, A., Aminian, A., & Erfanian, A. (2024). Real-time prediction of bladder urine leakage using fuzzy inference system and dual Kalman filtering in cats. Scientific Reports, 14(1), 3879.
5. Bhadra, N., Bhadra, N., Kilgore, K., & Gustafson, K. J. (2006). High frequency electrical conduction block of the pudendal nerve. Journal of neural engineering, 3(2), 180.
6. Jantz, M. K., Gopinath, C., Kumar, R., Chin, C., Wong, L., Ogren, J. I., ... & Gaunt, R. A. (2022). High-density spinal cord stimulation selectively activates lower urinary tract nerves. Journal of Neural Engineering, 19(6), 066014.
7. Pikov, V., McCreery, D. B., & Han, M. (2020). Intraspinal stimulation with a silicon-based 3D chronic microelectrode array for bladder voiding in cats. Journal of neural engineering, 17(6), 065004.
پارکینسون و تحریک عمقی مغز
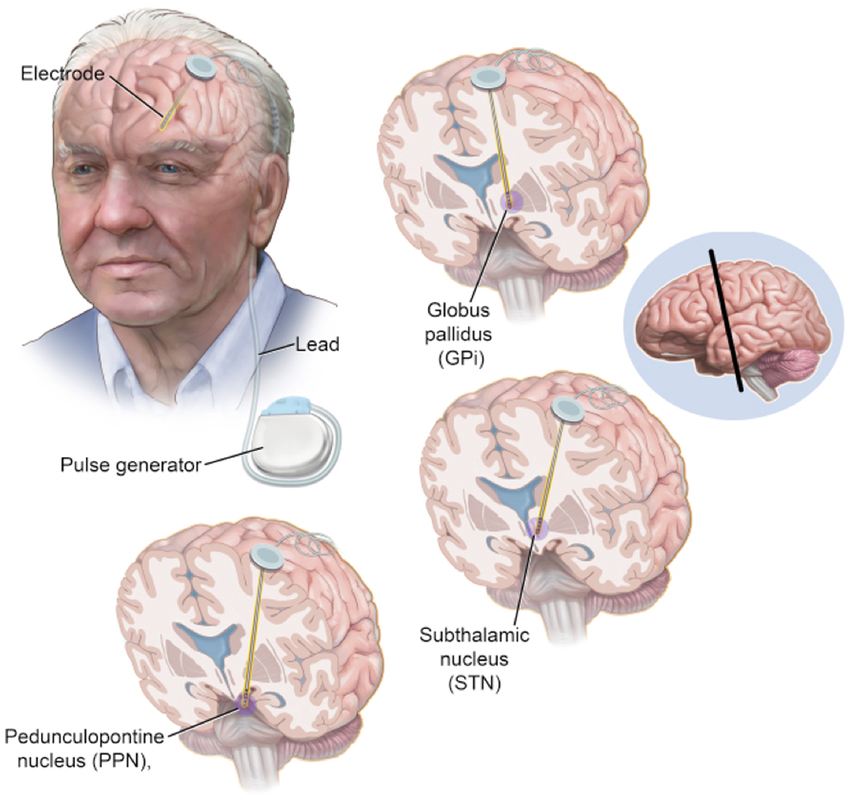
بیماری پارکینسون یک اختلال پیشرونده سیستم عصبی است که عمدتاً به دلیل کاهش تولید دوپامین در مغز ایجاد میشود و با علائمی مانند لرزش، سفتی عضلات، و مشکلات حرکتی شناخته میشود. این بیماری به مرور زمان میتواند زندگی روزمره فرد را مختل کند. در کنار درمانهای دارویی که معمولاً برای مدیریت علائم استفاده میشوند، تحریک عمقی مغز (Deep Brain Stimulation - DBS) یکی از روشهای پیشرفته برای کنترل علائم پارکینسون است. تحریک عمقی مغز یک روش جراحی پیشرفته است که به منظور تعدیل فعالیتهای غیرطبیعی مغز در بیماران مبتلا به پارکینسون و برخی دیگر از اختلالات حرکتی به کار میرود. در این روش، الکترودهای کوچک و قابل تنظیم در نواحی خاصی از مغز مانند هسته سابتالامیک (STN) یا گلوبوس پالیدوس داخلی (GPI) کاشته میشوند. این الکترودها با استفاده از یک دستگاه کاشتنی که زیر پوست قرار میگیرد، پالسهای الکتریکی تنظیمشدهای را به این نواحی ارسال میکنند. این پالسها باعث تعدیل سیگنالهای عصبی میشوند که در اثر کاهش دوپامین دچار اختلال شدهاند، و به این ترتیب، علائمی مانند لرزش، سفتی عضلات و برادیکینزی (کندی حرکت) کاهش مییابد. روش دی بی اس بهویژه برای بیمارانی که به درمان دارویی پاسخ مناسبی نمیدهند یا دچار عوارض جانبی شدید ناشی از داروها هستند، میتواند یک گزینه درمانی مؤثر و قابل تنظیم باشد.
مقالات مرتبط
1. Velisar, A., Syrkin-Nikolau, J., Blumenfeld, Z., Trager, M. H., Afzal, M. F., Prabhakar, V., & Bronte-Stewart, H. (2019). Dual threshold neural closed loop deep brain stimulation in Parkinson disease patients. Brain stimulation, 12(4), 868-876.
2.Blesa, J., Foffani, G., Dehay, B., Bezard, E., & Obeso, J. A. (2022). Motor and non-motor circuit disturbances in early Parkinson disease: which happens first?. Nature Reviews Neuroscience, 23(2), 115-128.
3. Poewe, W., Seppi, K., Tanner, C. M., Halliday, G. M., Brundin, P., Volkmann, J., ... & Lang, A. E. (2017). Parkinson disease. Nature reviews Disease primers, 3(1), 1-21.
4. Dayal, V., Limousin, P., & Foltynie, T. (2017). Subthalamic nucleus deep brain stimulation in Parkinson’s disease: the effect of varying stimulation parameters. Journal of Parkinson's disease, 7(2), 235-245.
5. Milekovic, T., Moraud, E. M., Macellari, N., Moerman, C., Raschellà, F., Sun, S., ... & Courtine, G. (2023). A spinal cord neuroprosthesis for locomotor deficits due to Parkinson’s disease. Nature Medicine, 29(11), 2854-2865.
تسکین درد
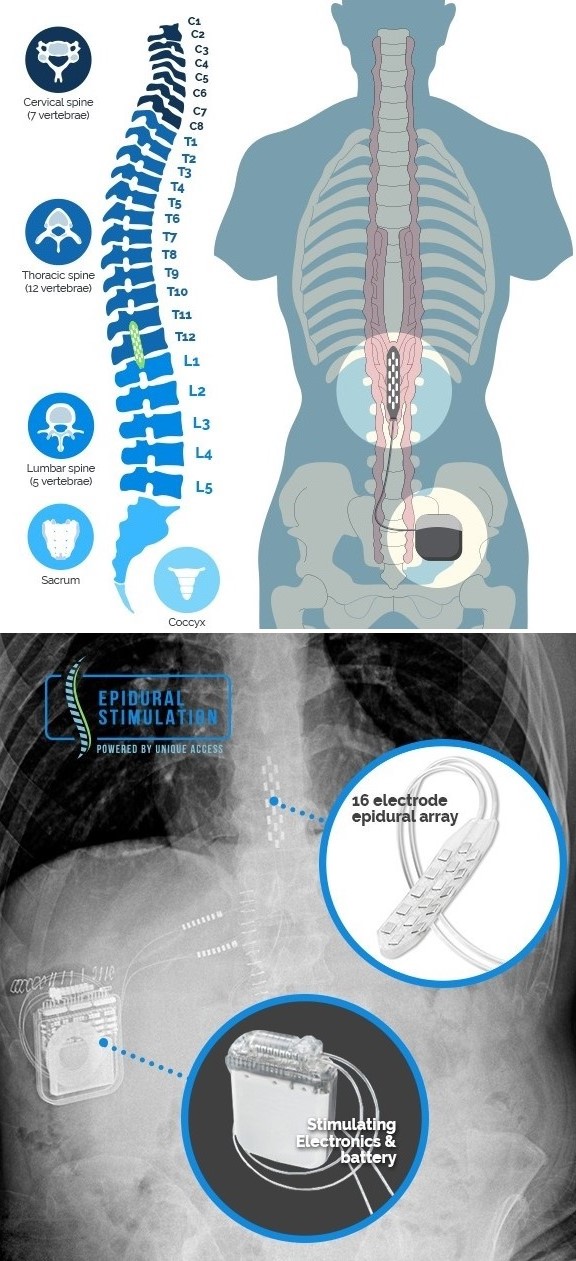
درد نروپاتیک یکی از انواع پیچیده و مقاوم به درمان درد است که ناشی از آسیب به سیستم عصبی میباشد. این درد معمولاً به صورت سوزش، تیرکشیدن، یا گزگز در ناحیه آسیب دیده احساس میشود و میتواند زندگی روزمره افراد را به شدت تحت تأثیر قرار دهد. از آنجایی که این نوع درد به درمانهای معمولی پاسخ نمیدهد، روشهای پیشرفتهتری مورد استفاده قرار میگیرند. یکی از این روشها، پروتز عصبی تحریک نخاعی اپیدورال است که در آن الکترود سطحی بهطور دائمی یا موقت در ناحیه قفسه سینهای نخاع قرار داده میشود تا با ارسال سیگنالهای الکتریکی با پارامترهای و الگوهای متنوع، انتقال درد به مغز را از طریق تئوری دروازه (Gate Theory) مهار کند. این روش میتواند به طور مؤثری درد را کاهش داده و کیفیت زندگی بیماران را بهبود بخشد.
نوعی دیگر از درمان غیرتهاجمی درد با استفاده از تحریک الکتریکی که با نام تحریک الکتریکی عصب از طریق پوست (TENS) شناخته میشود، یک روش غیرتهاجمی و مؤثر برای کاهش درد است. در این روش، الکترودهایی روی پوست در محل درد قرار داده میشوند و سیگنالهای الکتریکی با فرکانسهای مختلف به اعصاب منتقل میشود. این سیگنالها با مسدود کردن سیگنالهای درد در مسیرهای عصبی و همچنین تحریک تولید مواد شیمیایی مانند اندورفین (مسکن طبیعی بدن)، به کاهش درد کمک میکنند. روش TENS معمولاً برای دردهای مزمن مانند درد کمر، درد مفاصل و درد ناشی از آسیبهای عضلانی استفاده میشود.
تحریک الکتریکی برای تسکین درد، علاوه بر کاربردهای فیزیکی، جنبههای روانی درد را نیز کاهش میدهد. با استفاده از این تکنیک، بیماران نه تنها درد کمتری حس میکنند بلکه احساس کنترل بیشتری بر درد خود دارند. این روش عموماً بهعنوان یک درمان مکمل در کنار داروهای مسکن یا فیزیوتراپی استفاده میشود و یکی از مزایای اصلی آن، عدم نیاز به مصرف دارو و کاهش عوارض جانبی ناشی از مسکنها است.
